La Gravimétrie en Chimie Analytique
Une Exploration Complète
La
gravimétrie, ça sonne un peu comme une discipline obscure réservée aux
laboratoires poussiéreux, non ? Pourtant, derrière ce terme un brin intimidant
se cache une méthode analytique essentielle, simple dans son principe et
redoutablement efficace pour mesurer la quantité d'une substance avec une
précision à faire rougir les technologies les plus modernes. En gros, c'est
l'art de peser, mais en version scientifique et super structurée. On parle ici
d'une technique qui a traversé les âges et qui est toujours au top dans le
monde de la chimie analytique.
Pourquoi
est-ce qu'on s'y intéresse encore aujourd'hui ? Tout simplement parce que la
gravimétrie est à la fois robuste, fiable et économique. Pas besoin de machines
complexes ou de logiciels dernier cri, une bonne balance analytique, des
réactifs bien choisis et un peu de rigueur suffisent à obtenir des résultats
impressionnants. C'est une technique qui parle à tout le monde, des chimistes
chevronnés aux étudiants en pleine découverte de l'analyse quantitative.
Allons-y,
décortiquons ensemble ce que c'est, à quoi ça sert, et pourquoi on continue de
l'utiliser avec enthousiasme aujourd'hui. Vous verrez, la gravimétrie, ce n'est
pas si intimidant que ça. Préparez vos éprouvettes, on plonge dans le vif du
sujet !
La Gravimétrie : Qu'est-ce que c'est ?
La gravimétrie, c’est un peu comme une recette de
cuisine scientifique : vous suivez des étapes précises pour isoler et mesurer
un ingrédient clé (ou analyte) à partir d’un mélange complexe. Sauf qu’au lieu
de farine ou de sucre, vous travaillez avec des ions, des précipités et des
calculs chimiques. Son principe fondamental repose sur une idée simple mais
puissante : mesurer une masse pour déterminer une quantité.
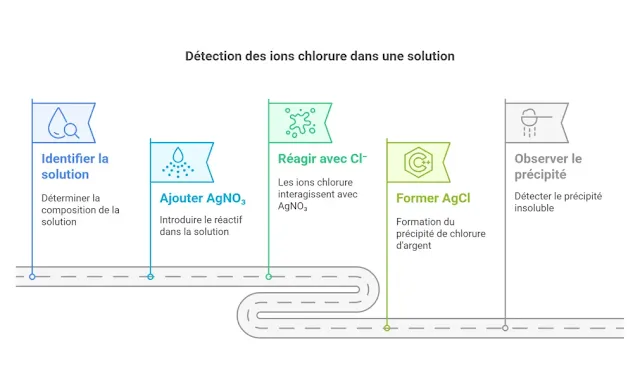
Prenons un exemple concret pour rendre cela plus
clair. Imaginez que vous voulez savoir combien de chlorure (Cl⁻) est présent
dans une solution aqueuse. Vous ajoutez du nitrate d’argent (AgNO₃), un réactif
qui réagit avec les ions chlorure pour former un précipité insoluble : le
chlorure d’argent (AgCl). Voici l’équation chimique qui décrit cette réaction :
Cl⁻
(aq) + AgNO₃ (aq) → AgCl (s) + NO₃⁻ (aq)
Le chlorure d'argent, sous forme de solide blanc, est récupéré par filtration, soigneusement lavé, puis séché. Une fois que vous avez pesé ce solide, il ne reste plus qu'à faire quelques calculs. Grâce à la relation entre la masse molaire de AgCl et celle du chlorure, vous pouvez déduire combien d'ions Cl⁻ se cachaient dans la solution initiale. Simple, non ?
 |
| Précipitation des chlorures d'argent |
Ce processus, qui peut sembler un peu fastidieux, a des avantages majeurs : il est incroyablement précis, ne nécessite pas de technologies coûteuses, et repose sur des principes chimiques fondamentaux que tout chimiste maîtrise.
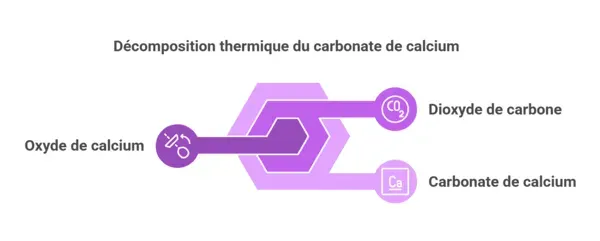
Un autre exemple courant est la décomposition thermique des carbonates, comme le carbonate de calcium (CaCO₃). Lorsqu’on chauffe ce composé, il se décompose en oxyde de calcium (CaO) et en dioxyde de carbone (CO₂) :
CaCO₃ (s) [chaleur] → CaO (s) + CO₂ (g)
Dans ce cas, la perte de masse due à la libération de CO₂ gazeux peut être utilisée pour déterminer la quantité de carbonate de calcium initialement présent. La gravimétrie ne se limite donc pas à la précipitation : elle inclut aussi la volatilisation (comme illustré ici), où la perte de masse devient l’indicateur clé.
 |
| Méthode de décomposition thermique |
Les étapes incontournables : le petit rituel gravimétrique
D’accord,
dit comme ça, la gravimétrie peut sembler être une simple affaire de pesée.
Mais en réalité, c’est tout un art avec un rituel bien précis, digne des
meilleurs chefs étoilés :
- La précipitation : l’art de faire apparaître un solide
Équation :
SO42−(aq)+BaCl2(aq) → BaSO4(s)+2Cl−(aq)
- La filtration : récupérer le précieux solide
- Le lavage : adieu, impuretés !
- Le séchage ou la calcination : stabiliser le solide
Équation :
Na2CO3 (s) + chaleur
→ Na2O (s)+CO2 (g)
- La pesée : le moment de vérité
Techniques Gravimétriques Courantes
La
gravimétrie, c'est un peu comme la magie de la chimie : elle regroupe plusieurs
techniques, chacune ayant son propre petit charme et adaptée à des situations
ou des substances spécifiques. Voici quelques-unes des méthodes les plus
courantes que vous allez adorer :
- Gravimétrie par Précipitation
Imaginez
que vous êtes un chef qui transforme des ingrédients en un plat délicieux. Dans
cette technique, on transforme un ion ou un élément en un précipité insoluble,
un peu comme faire un gâteau qui ne peut pas être mangé ! Une fois que ce
précipité est formé, on le sèche ou on le calcine (c’est un mot chic pour dire
qu’on le chauffe à haute température) avant de le peser pour connaître sa
masse.
Exemple
classique :
Prenons les ions sulfate (SO₄²⁻). En ajoutant une solution de chlorure de
baryum (BaCl₂), on obtient un beau précipité de sulfate de baryum (BaSO₄) qui
se forme sous nos yeux !
Équation
chimique :
SO42−(aq)+BaCl2(aq)→BaSO4(s)+2Cl−(aq)
- Gravimétrie par Volatilisation
Cette
technique, c’est un peu comme une danse avec la chaleur ! On chauffe un
échantillon pour libérer des composés volatils, comme si on faisait évaporer
l’eau d’une casserole. Ces composés sont ensuite capturés ou on évalue leur
quantité par la perte de masse de l’échantillon.
Exemple
classique :
Prenons le nitrate d’ammonium (NH₄NO₃). Quand on le chauffe, il se décompose
pour libérer du protoxyde d’azote (N₂O) et de l’eau (H₂O), un peu comme une
potion magique qui se transforme !
Équation
chimique :
NH4NO3(s) + chaleur → N2O(g)+2H2O(g)
- Gravimétrie par Séparation
Ici, on
joue aux détectives ! Dans cette approche, les composants d'un mélange sont
séparés par différentes méthodes physiques ou chimiques avant d'être pesés.
Cela peut inclure des techniques comme la centrifugation (où on fait tourner le
mélange pour séparer les éléments) ou l'extraction (où on utilise un solvant
pour extraire un composant spécifique). C'est un peu comme trier des bonbons
dans un sac pour ne garder que vos préférés !
Exemple
classique :
Imaginons un mélange de sels. En utilisant la centrifugation, on peut séparer
les sels selon leur densité, ce qui nous permet de les peser individuellement.
- Gravimétrie électrolytique
Moins courante, cette technique consiste à déposer une substance à partir d’une solution sur une électrode grâce à un courant électrique. Une fois le dépôt réalisé, on pèse l’électrode pour mesurer la masse déposée.
Exemple
: détermination
de la quantité de cuivre dans une solution par dépôt électrolytique de cuivre
métallique.
Matériel et Ustensiles Utilisés en Gravimétrie
Pour
réussir dans le monde de la gravimétrie, il vous faut du matériel précis et
robuste, un peu comme un bon chef a besoin de ses outils de cuisine. Voici les
principaux équipements qui vous seront indispensables :
- Balances Analytiques :
Ces balances sont comme des bijoux de précision, mesurant les masses avec une exactitude de 0,1 mg ou mieux. Pas question de se tromper ici ! - Creusets :
Fabriqués en porcelaine, platine ou alumine, ces récipients sont parfaits pour chauffer les précipités à haute température. Ils sont un peu comme les casseroles de la chimie. - Filtres et Supports :
Les filtres à porosité fine ou les creusets filtrants sont essentiels pour séparer les précipités de la solution, comme un bon tamis pour la farine. - Fours de Calcination :
Ces appareils permettent de chauffer les échantillons à des températures élevées pour éliminer les volatiles ou stabiliser les précipités. Pensez-y comme à un four à pizza, mais pour la chimie ! - Dessiccateurs :
Utilisés pour refroidir les précipités à l’abri de l’humidité avant la pesée. Ils sont comme des réfrigérateurs pour les précipités ! - Pinces et Gants :
Indispensables pour manipuler les objets chauds en toute sécurité. On ne veut pas se brûler les doigts, n'est-ce pas ?
 |
| Matériel et ustensiles de la gravimétrie |
Il est
vrai que les chimistes d'aujourd'hui, surtout dans les industries
pharmaceutique et alimentaire, travaillent principalement avec des équipements
de pointe comme l'HPLC (chromatographie liquide à haute performance), la GC
(chromatographie gazeuse), ou encore la spectrométrie d'absorption atomique.
Ces techniques sont rapides, automatisées et capables de traiter des
échantillons complexes avec une précision inégalée. Mais la gravimétrie, malgré
son grand âge (oui, on en parle depuis le 19ᵉ siècle, à une époque où les
chimistes portaient des lunettes rondes et des blouses bien amidonnées), reste
un pilier dans les laboratoires.
Pourquoi
est-elle encore sur le devant de la scène ? Eh bien, elle coche toutes les
cases.
- Une précision à toute épreuve
- Fiabilité absolue
- Accessible à toutes les bourses
- Un standard pour la validation
La gravimétrie, en raison de sa simplicité et de sa précision, est souvent
utilisée comme méthode de référence pour valider les résultats obtenus par des
techniques instrumentales. Par exemple, on peut l’utiliser pour vérifier la
concentration d’un étalon utilisé en HPLC ou en GC.
- Une solution de secours
En cas de panne d’un équipement sophistiqué ou d’une indisponibilité des pièces
de rechange, la gravimétrie reste une méthode fiable. Elle ne dépend que de
compétences humaines, d’un peu de matériel de base, et d’une bonne balance
analytique.
- Les contrôles basiques
Dans certains cas, comme la détermination de la teneur en cendres d’un produit
ou l’analyse d’un minéral, la gravimétrie reste une méthode simple et efficace.
Elle est encore largement utilisée dans des domaines spécifiques, par exemple
pour l’analyse des ciments ou des minerais.
- La pédagogie et la formation
Même dans des laboratoires ultramodernes, la gravimétrie est enseignée aux
jeunes chimistes comme un outil fondamental pour comprendre les bases de
l'analyse chimique. C’est une méthode qui développe la rigueur, la précision et
la compréhension des réactions chimiques.
- Des situations où l'instrumentation n'est pas rentable
Pour des laboratoires à budget
limité, ou lorsque les volumes d’analyse ne justifient pas l’achat d’un
appareil coûteux, la gravimétrie reste une alternative économique et fiable.
Une Méthode Traditionnelle au Service des Normes Modernes
Certaines
méthodes mentionnées dans les pharmacopées (comme la Pharmacopée Européenne,
la USP aux États-Unis, ou d'autres standards internationaux) et dans le Codex
Alimentarius relèvent directement ou indirectement de la gravimétrie. Bien
que ces normes s'appuient de plus en plus sur des techniques modernes comme la
chromatographie ou la spectrométrie, elles incluent encore des analyses
gravimétriques pour des besoins spécifiques. Voici quelques exemples et
applications actuelles de la gravimétrie dans ces domaines :
- Dans l'analyse des matières premières des médicaments (Pharmacopée)
La
gravimétrie intervient dans des cas où la simplicité, la précision et la
robustesse sont essentielles pour garantir la qualité des substances actives ou
des excipients. Voici quelques exemples concrets :
- Dosage des sulfates ou des
chlorures
:
La Pharmacopée Européenne et l’USP prescrivent des tests pour détecter ou quantifier les ions sulfates (SO₄²⁻) et chlorures (Cl⁻) dans certaines substances. Ces ions sont souvent précipités sous forme de sulfates de baryum (BaSO₄) ou de chlorure d’argent (AgCl), puis pesés pour déterminer leur concentration.
- Résidu à l'incinération
(teneur en cendres)
:
Ce test, basé sur la calcination à haute température, permet de mesurer la quantité de résidus minéraux laissés après la combustion d’un échantillon. La gravimétrie est utilisée pour peser le résidu final, garantissant que les matières premières ou excipients ne contiennent pas d’impuretés excessives. - Détermination de l'humidité
(méthode par dessiccation)
:
Les matières premières pharmaceutiques doivent contenir une quantité d’eau strictement contrôlée. La perte de masse après chauffage (ou calcination) est une méthode gravimétrique simple et efficace pour déterminer la teneur en eau ou en solvants résiduels.
 |
| Laboratoire moderne |
- Dans l'analyse des aliments (Codex Alimentarius)
Le Codex
Alimentarius, qui établit des standards internationaux pour la sécurité et
la qualité alimentaire, intègre aussi des méthodes gravimétriques dans
l’analyse des matières premières et des produits finis. Ces méthodes sont
particulièrement utiles pour des mesures simples mais précises. Voici quelques
applications :
- Teneur en cendres ou
minéraux :
Pour évaluer la composition minérale d’un aliment (farines, céréales, huiles, etc.), la méthode gravimétrique est incontournable. Un échantillon est incinéré à environ 550-600 °C, et les cendres résultantes sont pesées.
Cette méthode permet de s’assurer que les aliments respectent les limites réglementaires pour les minéraux et les contaminants inorganiques. - Dosage des matières grasses
(méthode Soxhlet)
:
Bien que souvent associée à des techniques d’extraction, cette méthode est gravimétrique dans son principe. Les lipides extraits d’un échantillon sont séchés et pesés pour déterminer leur concentration. - Teneur en humidité :
Comme pour les médicaments, les aliments doivent contenir une teneur en eau spécifique pour des raisons de conservation et de qualité. La méthode gravimétrique par dessiccation est utilisée pour ce test. - Dosage du calcium ou du
magnésium
:
Ces éléments peuvent être précipités sous forme d’oxalates ou de carbonates, puis calcinés et pesés sous forme d’oxydes stables (CaO ou MgO).
Alors
oui, les équipements sophistiqués dominent le contrôle qualité moderne, et
c’est tout à fait normal, vu leur rapidité et leur polyvalence. Cependant, la
gravimétrie conserve une place unique. Elle est un peu comme un couteau suisse
: fiable, précis, et toujours prêt à l'emploi, surtout pour des besoins
spécifiques ou dans des situations où les instruments modernes font défaut.
Bien
qu'elle ne soit pas la star des laboratoires d'aujourd'hui, la gravimétrie joue
encore un rôle essentiel, un peu comme ce vieux professeur dont on consulte
toujours la sagesse intemporelle. C'est une méthode exigeante qui demande
rigueur et attention aux détails. Même avec l'avènement de nouvelles
technologies, ses principes restent incontournables pour garantir des résultats
fiables et reproductibles.
Le principal conseil ? Ne jamais sous-estimer la valeur des bases, car c’est souvent dans les petites étapes que se cache la clé pour éviter les anomalies ou les OOS. Une bonne pratique gravimétrique est non seulement une garantie de qualité, mais aussi un atout précieux pour renforcer la fiabilité des analyses modernes.
Mot de l'auteur
La
gravimétrie, bien qu'elle puisse paraître classique voire vieillotte à
certains, reste un pilier de la chimie analytique, une preuve que simplicité et
rigueur peuvent rivaliser avec la technologie la plus avancée. J'espère que cet
article vous a permis de redécouvrir cette méthode sous un jour nouveau, et
surtout, de réaliser que même dans un monde de machines ultra-performantes, les
fondamentaux ont encore leur place et leur importance.
À tous
les chimistes, qu'ils soient novices ou chevronnés, je dirais ceci : prenez le
temps d’apprécier ces techniques qui, bien que modestes en apparence, sont la
base de toute analyse fiable. La gravimétrie, c’est un peu comme un vieux
manuel d'alchimie qui n’a pas pris une ride : elle a beaucoup à offrir à ceux
qui s’y attardent.
N'oublions
pas que la chimie est avant tout une science d'observation et de précision, où
chaque étape, aussi petite soit-elle, peut avoir un impact immense. Si cet
article a pu vous inspirer à prêter davantage attention aux bases et à
retrouver un peu de la magie de la gravimétrie dans vos travaux, alors j’aurai
atteint mon objectif.
Bonnes
analyses, et que la rigueur scientifique continue de guider vos pas, dans le
respect des traditions autant que dans l’innovation. Merci de m'avoir
accompagné dans ce voyage analytique !
Reda LOURGUIOUI
FAQ
1 Qu’est-ce
que la gravimétrie en chimie analytique ?
La gravimétrie est une méthode analytique basée sur la mesure de la masse d’un
composé pour déterminer la quantité d’un élément ou d’un ion dans un
échantillon. Elle repose sur des étapes comme la précipitation, la filtration,
le séchage et la pesée.
2 Quels
sont les avantages de la gravimétrie par rapport aux techniques modernes ?
Malgré la montée en puissance des méthodes instrumentales, la gravimétrie reste
:
- Très précise, avec des erreurs souvent
inférieures à 0,1 %.
- Fiable, car elle ne dépend pas
d’appareils électroniques.
- Accessible, avec un coût d’équipement
minimal.
3 Dans
quels secteurs la gravimétrie est-elle encore utilisée aujourd’hui ?
La gravimétrie est largement employée dans :
- L’industrie pharmaceutique,
pour vérifier la pureté des matières premières ou des produits finis.
- L’industrie
agroalimentaire, pour contrôler les concentrations en sels, minéraux ou
autres composés.
- Les laboratoires
académiques, pour valider d’autres méthodes analytiques ou établir des
standards.
4 Quels
sont les pièges à éviter lors d’une analyse gravimétrique ?
Les erreurs les plus courantes incluent :
- Une précipitation
incomplète, qui réduit la précision.
- Le lavage insuffisant des
précipités, laissant des impuretés.
- Une pesée inexacte due à un
séchage inadéquat ou à une balance mal calibrée.
5 Peut-on
considérer la gravimétrie comme une méthode obsolète ?
Pas du tout ! Bien qu’elle soit ancienne, elle reste essentielle pour des
analyses nécessitant une grande rigueur ou lorsque les équipements sophistiqués
(HPLC, GC, etc.) ne sont pas disponibles. Elle est aussi recommandée dans des
contextes réglementaires, comme ceux des pharmacopées et du Codex Alimentarius.
6 Comment
intégrer la gravimétrie dans un laboratoire moderne ?
Pour en tirer le meilleur parti, il est essentiel de :
- Former les chimistes aux
bonnes pratiques pour éviter les anomalies et OOS (Out of Specification).
- L’utiliser comme méthode
complémentaire pour valider ou croiser les résultats obtenus par des
techniques instrumentales.
- Maintenir un environnement
de laboratoire propre et bien équipé, notamment avec des balances
analytiques bien calibrées.







